每经记者:许立波 每经编辑:魏官红
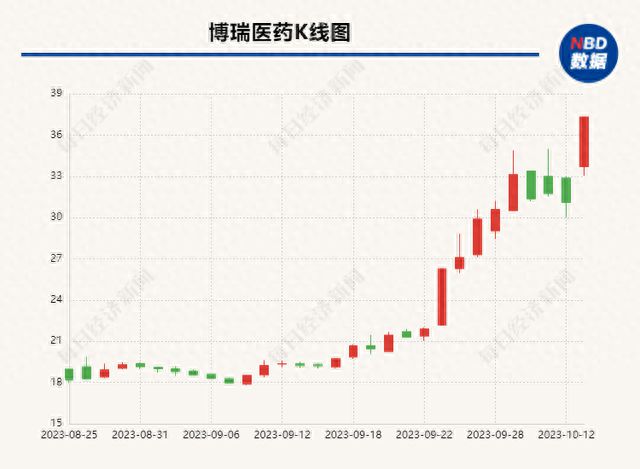
减肥药的热度依旧高涨。10月13日,减肥药概念股逆势上涨,博瑞医药(SH688166,股价37.32元,市值158亿元)、百花医药(SH600721,股价10.19元,市值39亿元)、众生药业(SZ002317,股价20.05元,市值171亿元)均触及涨停。
当日晚间,博瑞医药披露股票交易风险提示公告称,公司股票于10月13日涨幅达到20%;自9月25日以来,公司收盘价累计涨幅为57.91%。公司基本面未发生重大变化,也不存在应披露而未披露的重大信息。
有消息称,在10月12日公司投资者电话会议上,博瑞医药董事长袁建栋表示,其亲自试药公司自研的减肥药(BGM0504注射液),体重从91公斤降到76公斤。一位参与上述电话会议的机构分析师向《每日经济新闻》记者证实了此事。
博瑞医药则在当晚的公告中称,BGM0504注射液尚处于研发阶段。截至目前,减重和2型糖尿病治疗两项适应症均仅获得Ⅱ期临床试验伦理批件,其中2型糖尿病治疗的Ⅱ期临床已开始入组。待II期临床试验完成后,尚需经国家药监局确认确证性临床试验方案,开展并完成III期临床研究,并经国家药监局审评、审批通过后方可生产上市。
董事长“以身”试药,称效果显著
自诺和诺德的司美格鲁肽(商品名:Wegovy)横空出世以来,减肥药已成为生物医药领域炙手可热的赛道之一。
市场规模方面,摩根大通预计,到2030年,GLP-1(胰高血糖素样肽-1)受体激动剂相关药物的年销售额将超过1000亿美元。摩根大通还预测,中国减重药物市场规模有望于2030年达到149亿美元。
在减肥药惊艳的商业表现刺激之下,目前国内药企在GLP-1类减肥药研发领域也趋向内卷。德邦证券研报显示,截至今年6月14日,国内已经申请临床及以上的GLP-1类药物一共99个,已经批准上市的创新药10个,恒瑞医药、华东医药、石药集团等国内药企巨头也纷纷入场。同时,从IND申报数量来看,GLP-1类药物近三年临床申报已处于爆发期。2023年仅上半年临床申请数量就已达到47个,已超过去年全年的35个,足以窥见GLP-1类新药研发的火热。
资料显示,BGM0504注射液是博瑞医药自主研发的GLP-1和GIP(葡萄糖依赖性促胰岛素多肽)受体双重激动剂,可激动GIP和GLP-1下游通路,产生控制血糖、减重和治疗非酒精性脂肪性肝炎(NASH)等生物学效应,展现多种代谢疾病治疗潜力。公司2023年半年报披露,BGM0504注射液预计总投资规模6000万元,公司已累计投入3407.45万元用于该药物的开发。
有市场消息称,袁建栋在电话会议上指出,“在安全性上面我倒没有那么大担心。那我说自己做的药我就自己来试试,我试了一下,效果还不错。我大概打了差不多两个月,就从91公斤降到了76公斤,这个效果还是非常明显的”。
从药物靶点和机制上来说,BGM0504注射液与礼来的Tirzepatide(替尔泊肽)相似,两者同为GLP-1/GIP双受体激动剂。据界面新闻报道,10月13日,博瑞医药投关工作人员表示,自主研发的多肽类降糖药BGM0504注射液,尚处于研发阶段,减重和2型糖尿病治疗两项适应症均仅获得Ⅱ期临床试验伦理批件。对于董事长亲称药效一事,该工作人员表示,个体情况不能代表临床试验数据。
此外,据博瑞医药于12日披露的投资者调研报告,BGM0504注射液的Ia期临床试验初步数据显示:GM0504注射液安全性和耐受性良好,在2.5mg-15mg剂量递增范围内所有不良反应均为1~2级,未观察到3级及以上不良反应,暴露量(Cmax和AUC0-t)高于等剂量Tirzepatide(文献数据),具有线性比例化剂量反应关系。此外,药效学相关指标还观察到剂量相关性的体重降低,2.5mg-15mg剂量下给药期末随访(第8/15天)平均体重较基线期下降3.24%~8.30%。
调研报告还称,考虑到GLP-1过度激动容易带来一系列相关副作用,为了兼顾药效及安全性,博瑞医药适当下调了GLP-1活性但提高GIP活性,以GIP平衡部分GLP-1带来的副作用。在药物分子设计方面,公司发现替尔泊肽对于GLP-1及GIP双靶点分子侧链结构和连接位点存在改良空间,认为可通过优化侧链结构,调整侧链修饰位点,尝试提供药物活性并改善药代动力学特征。
是否涉嫌信披违规?
目前,市场争论的焦点在于:在BGM0504尚处于临床早期阶段的背景下,博瑞医药董事长袁建栋就“以身试药”,且将自己服用药物的个体情况介绍给参与公司电话会议的投资人,在客观上或助推公司股价上涨,此举是否涉及信披违规?

为此,《每日经济新闻》记者进行了多方咨询。上海明伦律师事务所王智斌律师向记者表示,上市公司应当在指定媒体披露重要信息,公司董事长自行发布有关药效的信息,涉嫌构成信息披露违规。
王智斌律师还表示,有关部门近年来对上市公司的信息披露提出了更加严格的要求,主要是为了在资本市场新旧生态转换的过程中,强化信息披露以让各参与方适应新生态,而且,随着市场的演变,很多规则也发生了变化,这都会在信息披露中有所展现,上市公司及相关责任人应该及时“更新”自己的知识,加强学习,不要出现信息披露总是“打补丁”的现象。
此外,国内某Biotech(生物科技)企业的首席医学官对记者表示:“处在研发阶段的药物如果不按照国家GCP(药品临床试验管理规范)随意给受试者(包括健康人和患者)使用肯定是不对的,但该董事长是个人行为,他的服药肯定不在国家对于研发试验的管理范畴,最多是企业内部的管理问题,但如果相关行为和报道的目的是为了股市,或者说引起了股价非正常的波动,那么相关证监部门是否认为行为不当或在其许可的范围内,这个就要由他们确认了。”
值得一提的是,博瑞医药此前就因信披违规收到监管部门的警示函。(详情可见每日经济新闻报道:利用上市公司涉新冠药消息内幕交易,下“本”上千万获利86万,他一审被判五年)
据上海市第三中级人民法院(以下简称上海三中院)公众号此前发布的消息,上海三中院经审理查明,某生物医药公司(即博瑞医药)系上海证券交易所科创板上市公司。2020年1月,该公司为应对新冠病毒疫情,开展抗病毒药物瑞德西韦的仿制工作,并于同年2月1日、2月11日先后完成小试批生产和中试批生产。2月11日晚,该公司发布公告宣布成功仿制开发了瑞德西韦原料药合成工艺技术和制剂技术,已经批量生产出瑞德西韦原料药。
受此利好消息影响,博瑞医药股价在随后三个交易日内涨超50%。
但后经核查,博瑞医药公告中所称“批量生产”实际为药品研发中小试、中试等批次的试验性生产,而非已完成审批并开始正式规模化、商业化生产销售瑞德西韦原料药和制剂。之后,上交所决定对博瑞医药予以监管关注,江苏证监局也向博瑞医药下发警示函。
针对董事长“以身试药”一事,记者于10月13日向博瑞医药发送了采访函,并多次致电公司证券事务部,但电话未获接听。





