华东医药前三季度营收净利双增,GLP-1、ADC等热门产品也披露最新进展。
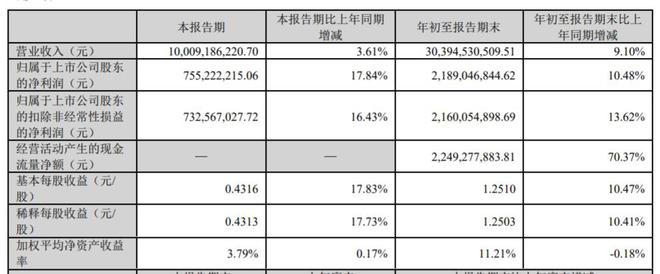
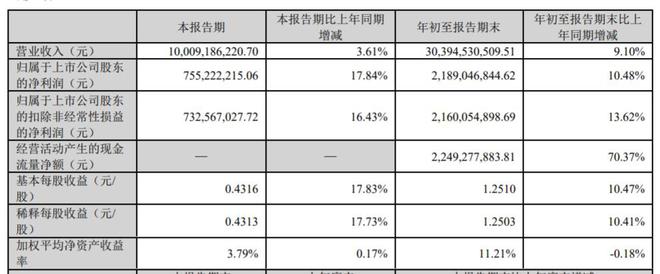
10月24日,华东医药(000963.SZ)披露2023年三季报,前三季度实现营业收入303.95亿元,同比增长9.1%;归母净利润21.89亿元,同比增长10.48%;归母扣非净利润21.6亿元,同比增长13.62%。华东医药称,如扣除股权激励费用及参控股研发机构等损益影响,实现归属于上市公司股东的扣除非经常性损益的净利润24.62亿元,同比增长19.36%。
单季度来看,华东医药2023年第三季度实现营业收入100.09亿元,同比增长3.61%;归母净利润7.55亿元,同比增长17.84%;归母扣非净利润7.33亿元,同比增长16.43%。
华东医药三季报部分数据
华东医药有医药工业、医药商业、医美和工业微生物四大业务板块。2023年前三季度,医药工业板块实现营业收入(含CSO业务)89.94亿元,同比增长9.48%;实现扣非归母净利润18.35亿元,同比增长13.41%。其中,第三季度实现营业收入29.4亿元,同比增长8.34%,实现扣非归母净利润6.09亿元,同比增长10.13%。
今年以来,由于人胰高血糖素样肽-1(GLP-1)受体激动剂的积极进展和布局,华东医药在二级市场备受关注。今年3月,GLP-1药物利拉鲁肽注射液糖尿病适应证在国内获批上市,肥胖或超重适应证在6月获批上市,均为国产首家。
除了上述的利拉鲁肽,华东医药的产品管线中还包括口服小分子GLP-1受体激动剂HDM1002,该候选药物的糖尿病适应证已于5月首获中美双IND批准,肥胖适应证的中国IND申请已于9月获批。
华东医药也在推进GLP-1类药物司美格鲁肽注射液,该药的原研产品来自丹麦制药巨头诺和诺德。此前华东医药在互动平台表示,司美格鲁肽注射液的糖尿病适应证目前处于临床Ⅲ期入组阶段,入组受试者数量正在逐步增加。华东医药在三季报的官方通稿中提到,该药的Ⅲ期临床试验已完成首例受试者入组及给药,后续也计划在国内启动用于肥胖或超重适应证的临床试验。
此外,华东医药还布局了GLP-1R/GCGR/FGF21R靶点的多重激动剂DR10624,正在国内与新西兰分别开展肥胖适应证的临床I期试验。三季报提到,目前,在内分泌领域,华东医药以GLP-1靶点为核心,已建立了涵盖口服、注射剂等多种剂型,包括长效和多靶点全球创新药和生物类似药相结合的GLP-1及相关靶点8款产品。
华东医药还提到,未来,公司将继续探索GLP-1相关靶点的创新项目,拓展减重、降脂、非酒精性脂肪性肝炎(NASH)、心血管获益、慢性肾脏病(CKD)等相关适应证研发工作。
在肿瘤领域,华东医药在积极布局当前大火的抗体偶联(ADC)药物,其中从美国ImmunoGen引进的索米妥昔单抗注射液是全球首个获批的针对叶酸受体α(FRα)阳性卵巢癌的ADC药物,已于2023年7月被CDE纳入优先审评,并落地海南博鳌先行区开出全国首批处方,在中国的生物制品许可申请(BLA)申请预计于2023年第四季度获得受理。
另外,华东医药首个自主研发ADC项目HDM2005已于2023年第一季度完成临床前候选化合物(PCC)确认,目前正持续推进临床试验审批(IND)开发,并计划于2024年内申报临床。
近几年,华东医药还在发力医美业务。10月17日,华东医药曾宣布,与韩国ATGC公司就含有A型肉毒杆菌毒素的注射液ATGC-110达成战略合作协议,获得其全球独家许可。从三季报可以看到,前三季度医美业务营业收入18.74亿元,同比增长36.99%。
截至10月24日收盘,华东医药报40.47元/股,涨0.47%,市值710亿元。





